Попередня сторінка: Вуглеводи: поняття, класифікація та по...
Наступна сторінка: Складні вуглеводи: сахароза, крохмаль,...
Пригадайте: хімічні властивості багатоатомних спиртів та альдегідів (за § 16 та 18).
Формула глюкози
Глюкоза є моносахаридом. Її молекулярна формула C6H12O6.

У відкритій формі існує близько 2 % молекул глюкози у водному розчині. У кристалах глюкоза існує тільки в циклічній формі.
Зі структурної формули відкритої форми видно, що глюкоза є біфункціональною сполукою: у її молекулі наявні характеристичні групи двох класів сполук — альдегідів та багатоатомних спиртів. Отже, глюкоза є альдегідоспиртом.
Фізичні властивості глюкози
• Безбарвна кристалічна речовина;
• без запаху;
• густина 1,54 г/см3;
• £ =146 °С, у разі нагрівання вище за цю температуру починає розкладатися, не доходячи до кипіння;
• добре розчиняється у воді: у 100 г води за 0 °С розчиняється 32 г глюкози, а за 25 °С — 82 г, погано розчиняється в органічних розчинниках;
• долодка на смак.

Хімічні властивості глюкози
Оскільки молекули глюкози містять альдегідну та кілька гідроксильних груп, то вона має виявляти хімічні властивості і альдегідів, і багатоатомних спиртів.
1. Якісна реакція на багатоатомні спирти. Як ви пам’ятаєте, для виявлення багатоатомних спиртів у розчинах використовують реакцію зі свіжодобутим купрум(ІІ) гідроксидом. Оскільки глюкоза є багатоатомним спиртом, то за її наявності в розчині так само зникає блакитний осад купрум(ІІ) гідроксиду і розчин набуває темно-синього забарвлення:
C6H12O6 + Cu(OH)2 —— сполука темно-синього кольору
Оскільки за цією реакцією виявляють будь-які розчинні багатоатомні спирти, то відрізнити один багатоатомний спирт від іншого, а також від моно- та дисахаридів неможливо.
2. Окиснення. Як і альдегіди, глюкоза вступає в реакції окис-нення. Можна використовувати різні окисники. У разі використання амоніачного розчину аргентум(І) оксиду виділяється срібло (реакція срібного дзеркала):
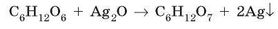
Продукт реакції — глюконова кислота — у молекулах містить карбоксильну групу:
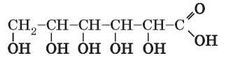
Глюконову кислоту використовують для приготування поширеного фармацевтичного препарату «Глюконат кальцію», який застосовують для поповнення Кальцію в організмі в разі його нестачі.
Альдегідна група глюкози також окиснюється купрум(П) гідроксидом, під час реакції з яким утворюється морквяно-червоний осад купрум(!) оксиду:
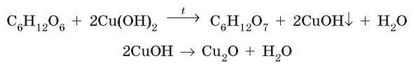
Хоча рівняння цієї реакції таке саме, як і для альдегідів, але спостереження трохи різняться. Після додавання розчину глюкози до осаду свіжодобутого купрум(ІІ) гідроксиду спочатку ми спостерігаємо зникнення осаду та зміну забарвлення розчину на темно-синє (мал. 25.1, а, б) — у цій реакції глюкоза виявляє властивість багатоатомного спирту. У разі нагрівання спостерігаємо виділення червоного осаду купрум(І) оксиду внаслідок окиснення глюкози (мал. 25.1, в, г). Завдяки цій особливості можна відрізнити глюкозу від багатоатомних спиртів та фруктози й сахарози, оскільки останні в реакцію окиснення не вступають.

Демонстраційний дослід: окиснення глюкози амоніачним розчином аргентум(і) оксиду
До амоніачного розчину аргентум(і) оксиду додаємо розчин глюкози й обережно нагріваємо на водяній бані або у стакані з гарячою водою (мал. а). Через деякий час на стінках колби срібло утворює наліт — дзеркало (мал. б). Тобто відбувається реакція срібного дзеркала, як і з альдегідами.

3. Відновлення. Для глюкози також характерна реакція відновлення. Водень за наявності каталізаторів (нікель, паладій) відновлює альдегідну групу до гідроксильної:

Продукт реакції — шестиатомний спирт сорбіт — дуже цінна речовина, з якої в промисловості добувають аскорбінову кислоту. Також сорбіт використовують як підсолоджувач. Хоча його солодкість на третину менша, ніж солодкість сахарози, але він майже не засвоюється організмом, тому його можна вживати людям із цукровим діабетом. Утім є одне «але»: у дозах понад 50 г він виявляє проносну дію.
4. Бродіння. Бродіння — це біохімічний процес, що відбувається під дією ферментів, які виділяють живі організми. Залежно від організмів розрізняють:
• спиртове бродіння: одноклітинні гриби дріжджі живляться вуглеводами, зокрема глюкозою, а продуктами їхнього травлення є етанол та вуглекислий газ:

Цей процес відбувається під час бродіння ягід та фруктів, його використовують для виготовлення вина. А ефект виділення вуглекислого газу використовують для приготування пухкого здобного тіста;
• молочнокисле бродіння відбувається під час перероблення вуглеводів молочнокислими бактеріями. Продуктом цього процесу є молочна кислота:

Ця реакція відбувається під час скисання молока і є основою виготовлення різноманітних молочнокислих продуктів — кисляку, йогуртів, сиру, сметани тощо (мал. 25.2). Молочнокисле бродіння також відбувається під час квашення силосу, капусти та інших овочів, що запобігає розвитку гнильних бактерій і сприяє тривалому зберіганню продуктів. Цей процес також відбувається в ротовій порожнині, але це спричиняє карієс зубів.
Глюкоза в природі
Глюкоза — один з основних продуктів обміну речовин у живих організмах. Вона утворюється в зелених частинах рослин у процесі фотосинтезу, що відбувається з поглинанням сонячного світла:


У рослинах глюкоза перетворюється на складні вуглеводи — крохмаль і целюлозу:
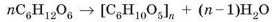
У тваринних організмах відбувається зворотний процес: тварини вдихають кисень, з їжею отримують глюкозу (та інші складні вуглеводи), а в організмі відбувається повне окиснення глюкози. Продукт реакції — вуглекислий газ — ми видихаємо:
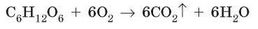

Отже, фактично тварини живуть за рахунок енергії Сонця, а засвоювати її допомагають рослини, які акумулюють цю енергію у вигляді глюкози.
Першим у світі процеси окиснення глюкози під час клітинного дихання дослідив наш співвітчизник В. О. Беліцер.
Процес фотосинтезу дуже поширений у природі: щорічно рослини синтезують близько 130 млрд тонн глюкози. Отже, проблеми її штучного синтезу не існує. Але звичайними методами органічної хімії синтезувати глюкозу та інші вуглеводи також можливо. Уперше глюкозу з метаналю синтезував Еміль Фішер.

ЛАБОРАТОРНИЙ ДОСЛІД № 2
Окиснення глюкози свіжоодержаним купрум(іі) гідроксидом
Обладнання: штатив із пробірками, пробіркотримач, пальник. Реактиви: розчини глюкози, купрум(П) сульфату, натрій гідроксиду.
Правила безпеки:
• для виконання дослідів використовуйте невеликі кількості реактивів;
• о стерігайтеся потрапляння реактивів на шкіру, в очі, на одяг; у разі потрапляння їдкої речовини змийте її великою кількістю води та протріть ушкоджене місце розведеним розчином боратної кислоти;
• під час нагрівання не торкайтеся руками гарячих предметів.
1. Добудьте купрум(ІІ) гідроксид: у пробірку налийте розчин лугу об’ємом 1-2 мл та додайте декілька крапель розчину купрум(ІІ) сульфату.
2. До осаду, що утворився, додавайте краплинами розчин глюкози до розчинення осаду купрум(ІІ) гідроксиду. Перемішайте суміш. Що відбувається? В який колір забарвлюється розчин? Які висновки про будову молекули глюкози можна зробити за результатами досліду?
3. Пробірку з отриманою сумішшю нагрійте на пальнику. Що відбувається? Які висновки про будову молекули глюкози можна зробити за результатами досліду?
Ключова ідея
Вуглеводи, зокрема глюкоза, є матеріальними носіями енергії, вони забезпечують перенесення енергії Сонця від рослин до тварин.
Контрольні запитання
389. До якої групи вуглеводів — моно-, ди- чи полісахаридів — відносять глюкозу? Чому?
390. Схарактеризуйте фізичні властивості глюкози.
391. Запишіть молекулярну та структурну формули глюкози. Характеристичні групи яких класів сполук наявні в молекулах глюкози?
392. У результаті якого процесу в природі утворюється глюкоза?
393. Схарактеризуйте поширеність і застосування глюкози. На яких властивостях воно ґрунтується?
394. Схарактеризуйте хімічні властивості глюкози. Відповідь проілюструйте відповідними рівняннями реакцій.
Завдання для засвоєння матеріалу
395. У двох пробірках містяться розчини: а) глюкози та гліцеролу; б) глюкози та фруктози. Як можна відрізнити вміст пробірок?
396. Складіть рівняння реакцій для здійснення перетворень за схемою: метан ^ вуглекислий газ ^ глюкоза ^ етанол ^ вуглекислий газ.
Комплексні завдання
397. Обчисліть масу глюкози, яку необхідно піддати бродінню, для одержання етанолу масою 55,2 г.
398. Обчисліть об'єм вуглекислого газу (н. у.), що виділяється під час спиртового бродіння глюкози масою 540 г.
399. Обчисліть масу кальцій карбонату, що утвориться під час поглинання вапняною водою газу, який виділиться у ході спиртового бродіння глюкози масою 18 г.
400. Обчисліть масу глюкози, яку піддали бродінню, якщо при цьому добуто етанол об'ємом 287,5 мл (густина етанолу 0,8 г/мл).
401. Суміш глюкози й фруктози масою 18 г обробили амоніачним розчином аргентум(І) оксиду. При цьому утворився осад масою 8,64 г. Обчисліть масову частку глюкози в суміші.
402. Газ, отриманий під час спиртового бродіння глюкози масою 90 г, був повністю поглинутий розчином із надлишковою кількістю натрій гідроксиду. Обчисліть масу солі, що утворилася в розчині.
403. Під час фотосинтезу було поглинуто 44,8 л вуглекислого газу. Обчисліть масу утвореної глюкози.
404. Обчисліть об'єм розчину спирту у воді з масовою часткою спирту 40 % (густина розчину 0,72 г/мл), що можна добути з глюкози масою 1 кг.
405. Суміш глюкози з інертними домішками масою 7,5 г піддали спиртовому бродінню. Утворений вуглекислий газ пропустили крізь вапняну воду, в результаті чого утворився осад масою 3,5 г. Визначте масову частку глюкози в початковій суміші.
Це матеріал з підручника Хімія 10 клас Григорович
Наступна сторінка: Складні вуглеводи: сахароза, крохмаль,...